2023-02-15 17:00
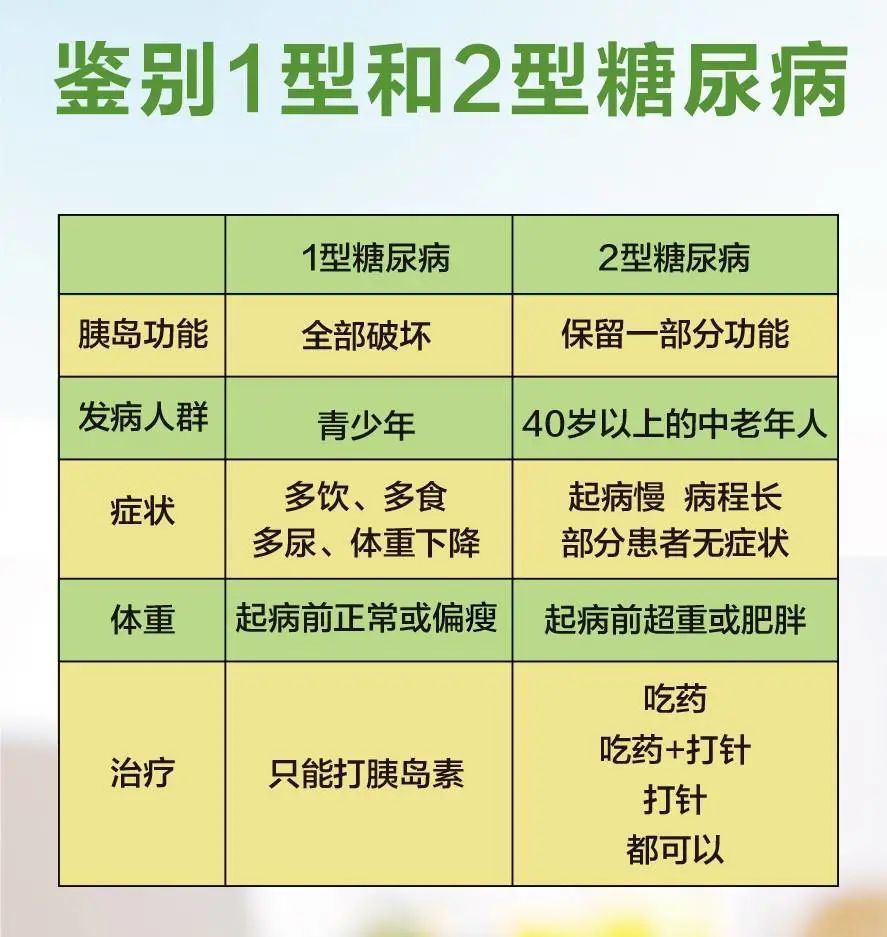
I型糖尿病是胰岛β细胞发生自身免疫破坏,导致胰岛素绝对缺乏而引起的营养物质代谢性异常疾病,占临床上糖尿病的5%。
I型糖尿病绝大多数是自身免疫性疾病,遗传因素和环境因素共同参与其发病,常导致患者出现多饮、多食、多尿、消瘦的“三多一少”症状,并有时会引起急性严重代谢紊乱、感染性疾病、慢性并发症相关问题,严重影响患者健康。
近日,北京大学邓宏魁教授团队及合作团队在《自然-医学》(Nature Medicine)、《自然-代谢》(Nature Metabolism)发表的两篇论文提示:在非人灵长类动物中的研究中,证明人多能干细胞来源的胰岛细胞治疗I型糖尿病安全、有效,新疗法未来有望治愈I型糖尿病。

全新方式制作“种子细胞”,利用化学小分子将人成体细胞重编程为多能干细胞
多能干细胞是干细胞与再生医学的关键“种子细胞”,如果人们能够像“农业制种”一样获得这种“种子细胞”,将解决再生医学面临的细胞来源问题。邓宏魁团队很早就开始探索获得“种子细胞”的路径,与诺奖成果不同,他们选择了利用化学小分子将人成体细胞重编程为多能干细胞。
2022年,邓宏魁研究组利用化学小分子诱导的方法,建立了一种安全、简单、易于调控和标准化的人多能干细胞制备技术。“种子细胞”的“制种”技术实现了操作的简便灵活以及调控的可逆可控,该研究成果发表在国际科学期刊《自然》杂志。
利用新的种子细胞,完成“仿真”治疗,即首先制备“种子细胞”,其次把它分化成胰岛细胞,最后将胰岛细胞供给患者
20多年来,邓宏魁研究组对基础研究的坚持和续接,让团队在整个流程的三个阶段都实现了原创性突破。2005年,邓宏魁研究组率先采用模拟胰腺体内发育分步定向诱导分化的策略,并于2007年初步建立了诱导人多能干细胞定向分化为胰腺β细胞的技术方案,为利用人多能干细胞治疗糖尿病奠定了早期的研究基础。
团队最终找到了更佳的移植部位——腹直肌前鞘,使得手术更安全、易行,没有出血和凝血风险。不只如此,新方案可支持移植细胞早期存活和功能长期维持。数据还表明新方法下的胰岛素标志物分泌水平提升5倍以上,这意味着在未来的临床治疗中,患者需要植入的外源细胞更少,安全性更高。
上述非人灵长类动物模型上的成功并没有让研究的“征途”告一段落。未来还要解决免疫排异的问题,比如对种子细胞进行修饰后,避免机体免疫系统对移植细胞产生排异反应。期待邓宏魁教授团队在干细胞治疗I型糖尿病这一研究项目中取得更大成绩,早日造福广大患者!